Einführung für Lehrende
| Autoren: | |
| Publikation: | 12.1.2009 |
| Lernstufen: | 2, 3 |
| Herkunft: | Sonnentaler, Berlin |
Wasser weist eine Reihe von ungewöhnlichen Eigenschaften auf. Dazu gehören u. a. seine anomale Dichte, sein hoher Schmelz- und Siedepunkt und seine große Wärmekapazität.
Wasser ist ein Molekül, das aus zwei Wasserstoffatomen und einem Sauerstoffatom besteht. Die chemische Formel lautet H2O. Zwischen den Atomen besteht eine kovalente Bindung (Atombindung). Eine kovalente Bindung tritt auf, wenn Nichtmetalle eine chemische Bindung eingehen.
Wasser gehört zu den Wasserstoffverbindungen, in denen die Wasserstoffatome eine positive Partialladung besitzen. Aufgrund der positiven Partialladung der Wasserstoffatome und der negativen Partialladung des Sauerstoffatoms ergibt sich der Dipolcharakter des Wassermoleküls. Die beiden OH-Verbindungen schließen einen Winkel von 104°40´ ein.
Der Dipolcharakter des Wassermoleküls ermöglicht die Assoziation (Zusammenlagerung) zu größeren Molekülverbänden. Es entstehen größere Gebilde der Formel (H2O)n, was eine scheinbare Erhöhung der relativen Molekülmasse von 18 auf n×18 bedeutet.
Neben den Assoziationen tragen Wasserstoffbrückenbindungen zur Ausbildung größerer Gebilde bei. Jedes Wasserstoffatom im Wassermolekül kann aufgrund seiner positiven Partialladung außer dem kovalent gebundenen Sauerstoffatom noch ein weiteres Atom mit einem freien Elektronenpaar anlagern. Diese Bindung beruht auf elektrostatischer Anziehung und wird als Wasserstoffbrückenbindung bezeichnet. Sie ist im Vergleich zu kovalenten Bindungen relativ schwach. Während eine kovalente OH-Bindung eine relative Bindungsenergie von 463 kJ/mol besitzt, beträgt die molare Bindungsenergie einer Wasserstoffbrücke zwischen Wasserstoff und Sauerstoff nur etwa 4,3% der Energie der entsprechenden kovalenten Bindung.
Im festen Zustand ist jedes Wassermolekül tetraedrisch von vier weiteren Wassermolekülen umgeben. Jedes Sauerstoffatom ist dann an zwei Wasserstoffatome durch kovalente Bindungen und an zwei weitere Wasserstoffatome durch Wasserstoffbrückenbindungen gebunden. Durch das Netzwerk von Wasserstoffbrückenbindungen kommt es zur Ausbildung einer offenen Struktur.
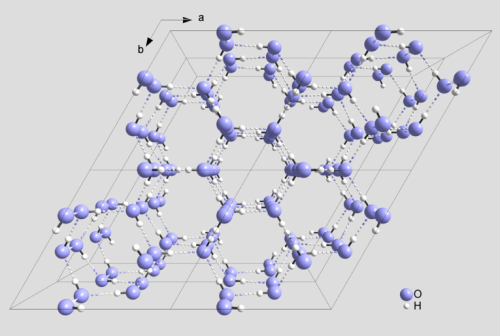
Abb. 1: Ausschnitt aus der Struktur von Eis
Diese Struktur bricht teilweise zusammen, wenn durch eine Temperaturerhöhung die zunehmende Molekularbewegung einige der Wasserstoffbrückenbindungen aufbricht. Die Dichteanomalie des Wassers lässt sich also folgendermaßen erklären:
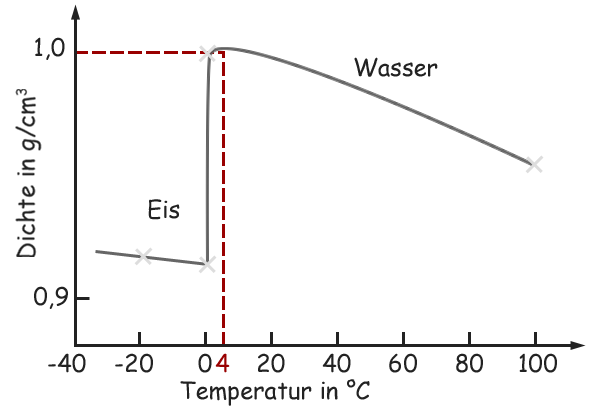
Abb. 2: Dichte von Wasser und Eis in Abhängigkeit von der Temperatur
Beim Schmelzen des Eises können sich die Wassermoleküle durch den Zusammenbruch der strengen Gitterordnung enger aneinander lagern, was zu einer Zunahme der Dichte führt und bei 4°C ein Maximum erreicht. Mit zunehmender Temperatur nimmt infolge der größeren Raumbeanspruchung durch stärkere Wärmebewegung die Dichte wieder ab.
Die Dichte eines Stoffes ergibt sich aus dem Quotienten der Masse m und des Volumens V eines Körpers. Sie ist für Wasser mit 1,000 g/cm3 bei 4°C am größten, nimmt bei Abkühlung bis auf 0°C auf 0,998 g/cm3 ab und reduziert sich dann sprungartig beim Gefrieren auf unter 0,92 g/cm3.
Als Modell für den Aufbau eines Wassermoleküls wird der menschliche Körper gewählt. Hierbei sind die Hände die beiden Wasserstoffatome und die Füße die freien Elektronenpaare des Sauerstoffs. Stellt man sich dann mit auseinandergestellten Beinen, einer Drehung in der Hüfte um 90° und ausgestreckten Armen hin, ergibt sich eine tetraedrische Gestalt. Zur Veranschaulichung der Wasserstoffbrückenbindung kann eine Hand jeweils einen Fuß ergreifen.
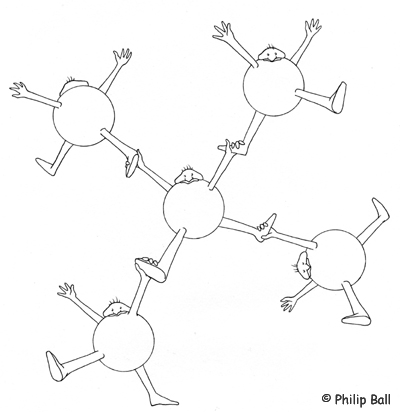
Abb. 3: Modell zur Veranschaulichung der Wasserstoffbrückenbindung (© Philip Ball)
Im Eis ist jedes Wassermolekül durch Wasserstoffbrückenbindungen mit vier weiteren Wassermolekülen verbunden. Es bildet sich ein hexagonaler Ring aus.
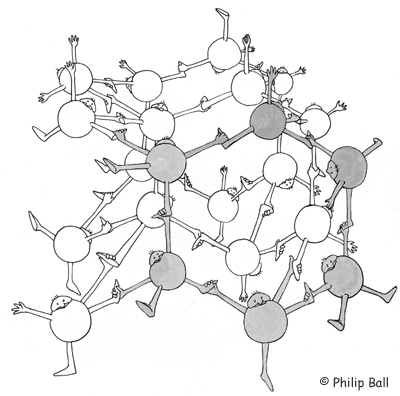
Bild 4: Ausbildung eines hexagonalen Rings im Eis (© Philip Ball)
Letzte Aktualisierung: 14.10.2024






